28 августа, 06:05
Минздрав предлагает этическую экспертизу для индивидуальных биотехнологических препаратов

Vademecum Live
Этическая экспертиза БТЛП может стать обязательной Минздрав РФ подготовил поправки в закон Об обращении лекарственных средств которые впервые вводят процедуру этической экспертизы для биотехнологических лекарственных препаратов БТЛП создаваемых в клиниках индивидуально для конкретных пациентов Если документ утвердят он вступит в силу 1 сентября 2026 года Экспертизу будет проводить специально созданный этический комитет оценивающий обоснованность применения препарата Требования к экспертам и форма заключения будут определяться правительством
Наука22 часа назад
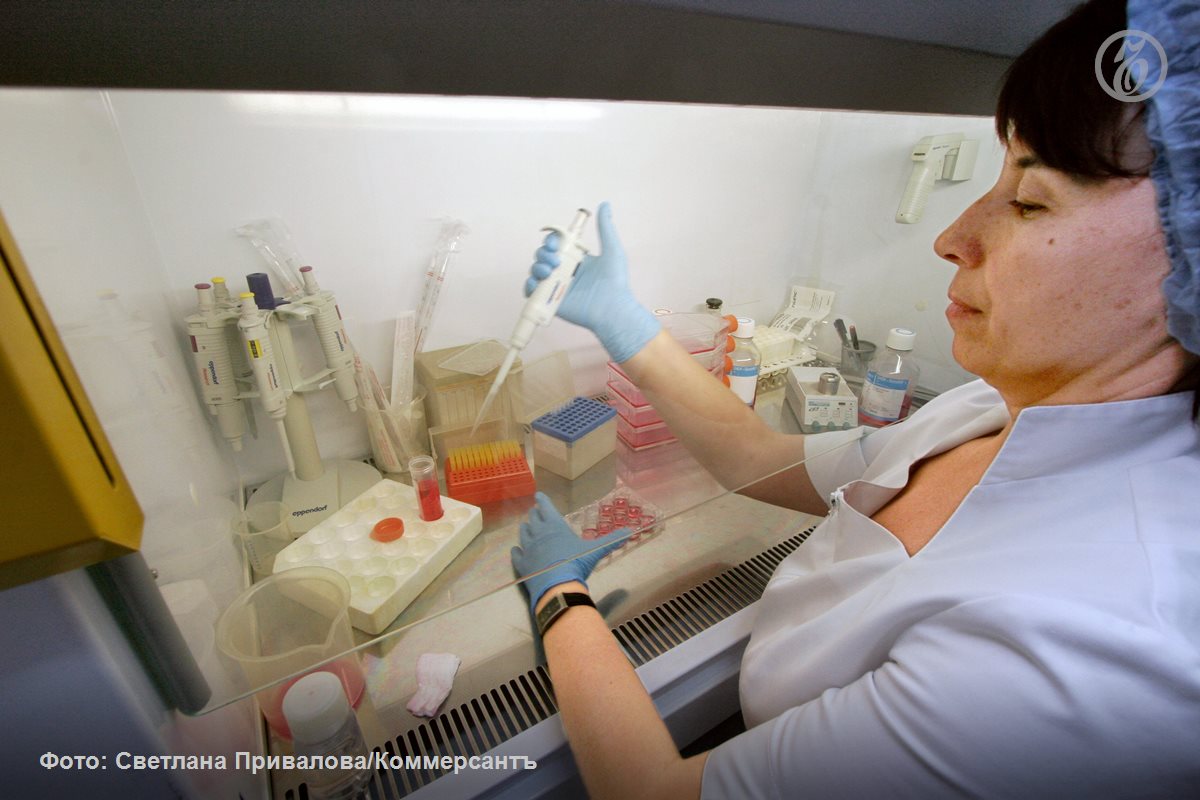

Коммерсантъ
Минздрав подготовил законопроект который введет с 1 сентября 2026 года процедуру этической экспертизы для биотехнологических лекарственных средств Особенность таких препаратов в том что они разрабатываются индивидуально для каждого пациента с использованием его биологического материала клеток или тканей Планируется создать специальный комитет который будет заниматься защитой прав пациентов включая оценку целесообразности применения таких препаратов для людей с жизнеугрожающими заболеваниями Поделитесь вашим мнением о телеграм канале Ъ
Наука7 часов назад

Без рецепта
Эксперты за проверку биотехнологических лекарств на этику Минздрав планирует ввести процедуру этической экспертизы для таких препаратов с 1 сентября 2026 года Их изготавливают в медицинской организации индивидуально для каждого пациента с использованием его же биологических материалов Такими лекарствами лечат рак аутоиммунные инфекционные и сердечно сосудистые заболевания Этической экспертизой БТЛП займётся отдельный комитет Проект поправок к закону Об обращении лекарственных средств подготовлен по поручению Татьяны Голиковой Этическая экспертиза нужна чтобы гарантировать безопасность и благополучие пациентов в том числе с жизнеугрожающими заболеваниями Эксперты инициативу вице премьера поддерживают Этическая экспертиза становится барьером который предотвращает использование таких препаратов в ситуациях которые могут быть не в интересах пациента или идут вразрез с общепринятыми моральными и этическими нормами объясняет член экспертного совета по орфанным заболеваниям при комитете Госдумы по охране здоровья Наталья Смирнова По мнению руководителя правовой службы фонда Подсолнух Марии Посадковой новая комиссия будет контролировать этапы создания и применения подобных средств оценивать риски для пациента а также проверять насколько его решение было осознанным Исполнительный директор Высшей школы онкологии Полина Шило считает что введение этической экспертизы позволит сделать процесс более регулируемым Независимый комитет будет оценивать действительно ли применение индивидуального препарата оправдано насколько пациент информирован и защищен нет ли конфликта интересов Без рецепта
Наука6 часов назад

Право на здоровье
Минздрав планирует ввести этическую экспертизу для обоснования возможности применения индивидуальных биотехнологических лекарств БТЛП в медучреждениях Проект закона опубликован на портале проектов нормативных актов Он вносит изменения в ФЗ Об обращении лекарственных средств В пояснительной записке отмечается что документ нужен в целях создания этического комитета по проведению этической экспертизы этической обоснованности возможности применения БТЛП предназначенного для применения в соответствии с индивидуальным медицинским назначением и специально изготовленного для конкретного пациента непосредственно в медицинской организации в которой применяется такой БТЛП Авторы документа подчеркивают что сейчас не приняты нормы регулирующие процедуру этической экспертизы таких препаратов а она целесообразна для обеспечения безопасности и благополучия пациентов Поэтому документ дополняет ФЗ и закрепляет проведение такой экспертизы а также регламентирует создание этического комитета Согласно тексту законопроекта кабмин будет определять требования к квалификации и опыту работы по экспертной оценке научных медицинских и этических аспектов применения индивидуальных БТЛП предъявляемые к экспертам этического комитета а также форму заключения Если закон примут он начнет действовать 1 сентября 2026 года
Наука1 день назад


СОВЕТНИК ПРЕЗИДЕНТА
Минздрав РФ подготовил проект поправок в 61 ФЗ Об обращении лекарственных средств Инициатива касается особой категории медикаментов биотехнологических лекарственных препаратов БТЛП которые предназначены для применения в соответствии с индивидуальными медицинскими назначениями и изготавливаются в клиниках специально для конкретных пациентов К таким препаратам относятся и изготовленные с использованием биологического материала клеток или тканей Планируется создать специальный комитет который будет заниматься оценкой целесообразности применения таких препаратов Экспертиза будет осуществляться специально созданным этическим комитетом задачей которого станет выдача заключения об этической обоснованности применения индивидуального препарата Квалификационные требования к экспертам а также форма заключения будут устанавливаться правительством Поправки также вносятся в статью 13 61 ФЗ где закрепляется возможность проведения этической экспертизы как отдельного вида оценки
Наука7 часов назад

Significo-АМГ
Минздрав разработал поправки в закон Об обращении лекарственных средств согласно которым в России появится этическая экспертиза для обоснованности применения индивидуальных биотехнологических препаратов www kommersant ru doc 7991307
Наука6 часов назад

ГКУ АЗ (КС) ДЗМ
Минздрав предложил изменения в Закон об обращении лекарственных средств Проектом предлагается законодательно закрепить проведение этической экспертизы индивидуального биотехнологического лекарственного препарата и создание этического комитета в указанных целях Требования к квалификации и опыту работы экспертов по оценке научных медицинских и этических аспектов применения биотехнологического лекарственного препарата будут устанавливаться Правительством РФ Проведение этической экспертизы является целесообразным для обеспечения безопасности и благополучия пациентов в том числе с жизнеугрожающими заболеваниями при последующем применении индивидуальных биотехнологических лекарств соблюдения норм действующего законодательства и обеспечения соответствия принципам заложенным Хельсинкской декларацией Всемирной медицинской ассоциации Пояснительная записка АГЕНТСТВО ПО ЗАКУПКАМ ДЗМ ПОДПИСАТЬСЯ Документ Проект федерального закона О внесении изменений в Федеральный закон Об обращении лекарственных средств
Наука5 часов назад
Похожие новости



 +2
+2



 +16
+16








 +6
+6



 +3
+3



 +4
+4

Узбекистан вводит международные стандарты регистрации медицинских изделий
Общество
46 минут назад


 +2
+2
Сотрудничество России и Беларуси в сфере ИИ и открытие сварочной лаборатории в ДВФУ
Общество
1 день назад


 +16
+16
Минстрой России предлагает продлить срок действия правил аттестации экспертов до 2032 года
Общество
1 день назад




Правительство России утвердило план мониторинга правоприменения на 2026 год
Политика
3 часа назад


 +6
+6
Владивосток и Ростовская область открывают новые классы и центры для детей с особыми потребностями
Общество
1 час назад


 +3
+3
Продление программы поддержки производителей детских игрушек до 1 декабря
Общество
1 день назад


 +4
+4
